高血压是以血压升高为主要特点的全身性疾病。我国18岁及以上居民高血压患病率为 27.5%,其中 18~44 岁、45~59 岁和 60 岁及以上居民高血压患病率分别为 13.3%、37.8%和 59.2%。我国居民高血压患病率总体呈上升趋势,目前成人高血压患病人数估计为 2.45 亿。高血压是导致冠心病、脑卒中等心血管疾病、死亡的主要原因之一。(成人高血压食养指南(2023 年版)国家卫生健康委办公厅 )。
天然免疫系统
天然免疫系统由粘膜屏障、多种免疫细胞(巨噬细胞、中性粒细胞、NK细胞等)和免疫分子(包括趋化因子、细胞因子和补体蛋白)组成,其中中性粒细胞是循环中最丰富的白细胞类型,而巨噬细胞是各种组织中最常见的免疫细胞类型。
巨噬细胞
Pflugers Arch. 2017
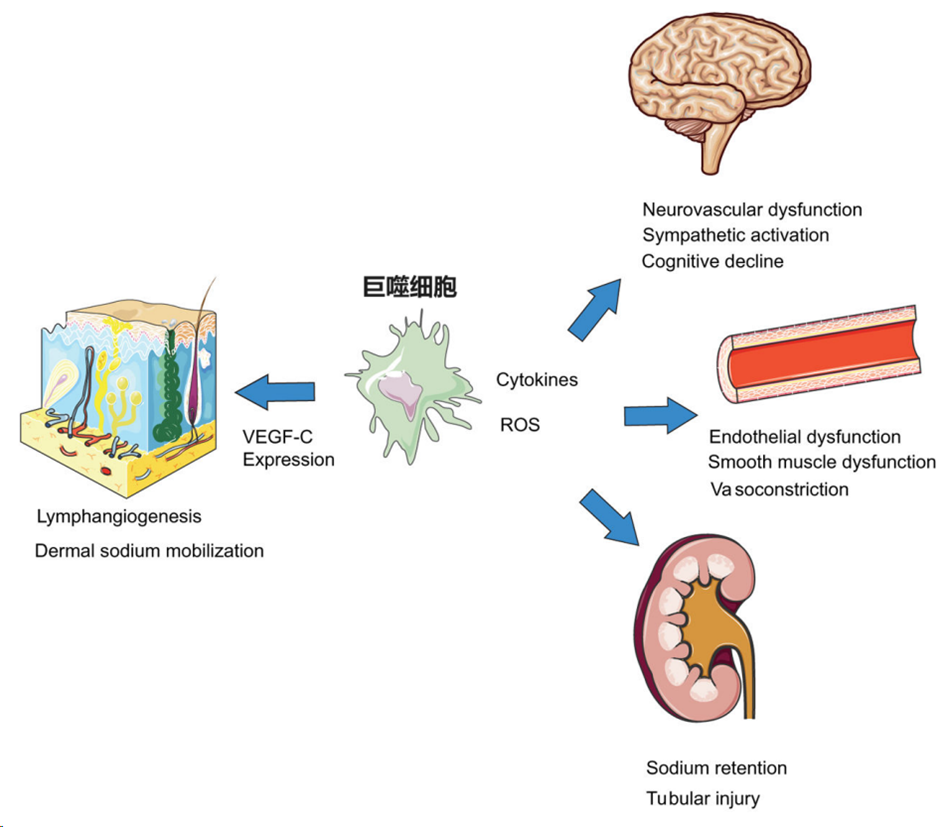
巨噬细胞通过产生炎症细胞因子和活性氧(ROS),直接损害血管内皮细胞和平滑肌功能,导致血管收缩,导致高血压。肾血管中类似的过程损害肾脏钠排泄也导致血压升高。巨噬细胞诱导的肾实质损伤也可引起高血压中可见的肾小管损伤和间质纤维化。在大脑中,不同的巨噬细胞群增加了高血压神经炎症和交感神经元的激活。大脑中巨噬细胞的数量也介导了与高血压相关的神经血管功能障碍和认知功能下降。通过不同的机制,巨噬细胞增加VEGF-C的表达,导致淋巴管生成和淋巴流量增加。这些过程可以调动皮肤的钠储存,从而可能作为一个重要的肾外调节钠稳态,从而调节血压。
中性粒细胞
Int J Mol Sci. 2020
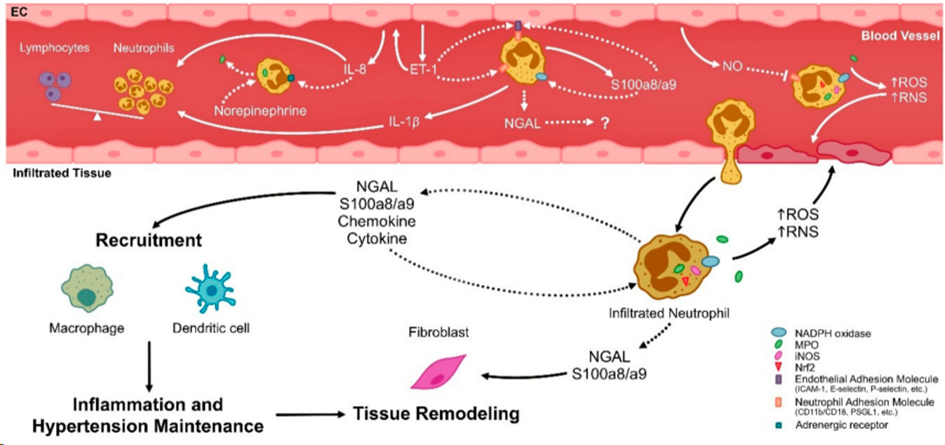
在动脉高血压(arterial hypertension,AH),激活的中性粒细胞分泌IL-1β、IL-8等,内皮细胞分泌endothelin-1 (ET-1),增加循环中性粒细胞(中性粒细胞总数或中性粒细胞/淋巴细胞比率(NLR))。
IL-8可诱导中性粒细胞中的肾上腺素能受体表达,促进其激活。ET-1会增加粘附分子的表达,有利于内皮细胞-中性粒细胞的相互作用和粘附过程。
同样,中性粒细胞分泌的S100a8/a9可能诱导内皮细胞粘附分子表达。
活性氧(ROS)促进中性粒细胞粘附和滚动过程,而内皮细胞产生的一氧化氮(NO)抑制中性粒细胞粘附和滚动。
循环中性粒细胞和浸润组织的中性粒细胞,通过NADPH氧化酶、髓过氧化物酶(MPO)作用,产生活性氧(ROS)和活性氮(RNS)。这种氧化和氮化应激可能导致内皮损伤,导致血管功能障碍和AH。
另一方面,中性粒细胞通过分泌细胞因子、趋化因子、中性粒细胞明胶酶相关脂钙蛋白(NGAL)或S100a8/a9,促进组织损伤和免疫细胞募集,如巨噬细胞和树突状细胞。反过来,这些分子可能诱导对血液中性粒细胞的自分泌效应,促进它们的激活,以及对浸润的组织,促进重塑过程,使AH永久化。
树突状细胞
Hypertension Research (2022)
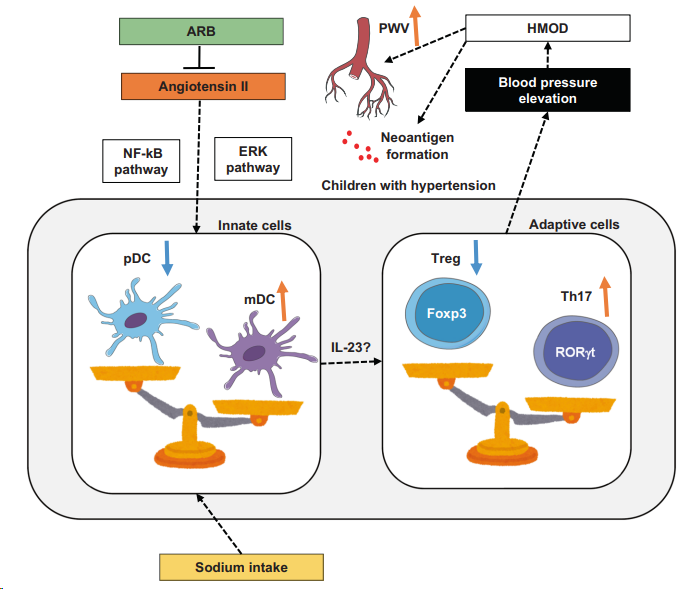
高血压患者,树突状细胞失衡,pDC下降,mDC上调,进而引起T细胞亚群失调,Treg下调,Th17上调,参与T细胞介导的高血压。
于嗜酸性粒细胞和嗜碱性粒细胞在高血压发病机制中作用的数据有限。
适应性免疫系统
KIDNEY360 2023
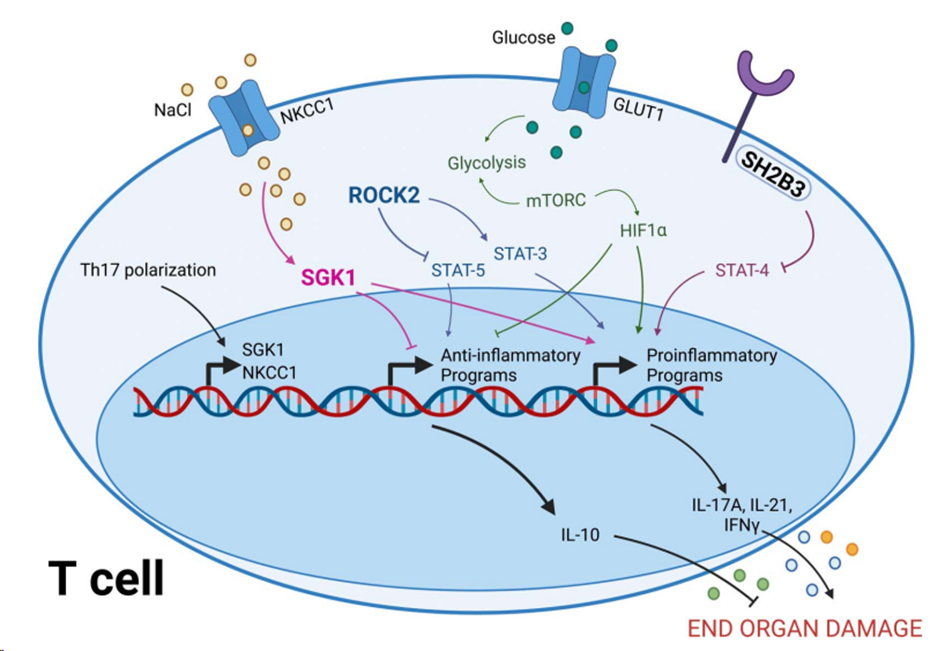
T细胞通过NKCC1摄取氯化钠来响应氯化钠的增加,NKCC1被感知为SGK1。SGK1促进促炎信号通路,抑制炎症通路。
ROCK2磷酸化STAT3,并降低STAT5的磷酸化,这也使细胞向炎症表型转变。
炎症性Th1、Th2,特别是Th17细胞利用糖酵解产生能量。这是由细胞表面Glut1的表达和mTORC活性调控的。mTORC信号通路涉及HIF1a,一种促进Th17分化的转录因子。SH2B3作为STAT4信号通路的负调控因子,从而为炎症激活提供了一个刹车。
通过操纵这些途径来调节炎症平衡,可以影响T细胞产生的细胞因子的类型,从而影响对靶器官的损伤。
在高血压患者中,B细胞及其抗体在终末器官损伤中发挥作用。
高血压反应被T调节细胞(Treg)及其抗炎细胞因子IL-10可以抑制高血压的发生。
参考资料
A. Justin Rucker and Steven D. Crowley. The role of macrophages in hypertension and its complications,Pflugers Arch. 2017 April ; 469(3-4): 419–430. doi:10.1007/s00424-017-1950-x
Patricio Araos, Stefanny Figueroa, Cristián A Amador.The Role of Neutrophils in Hypertension.Int J Mol Sci. 2020 Nov 12;21(22):8536. doi: 10.3390/ijms21228536.
Akinori Higaki,Masaki Mogi. Dendritic cells as potential initiators of immune-mediated hypertensive disorders,Hypertension Research (2022) 45:527–529https://doi.org/10.1038/s41440-021-00830-y
Fehrenbach et al.Modulating T Cell Phenotype and Function to Treat Hypertension,KIDNEY360 4: 534–543, April, 2023













